近日,由臻和科技集团旗下全资子公司臻悦生物科技江苏有限公司(以下简称“臻悦生物”)生产研发的5款人基因检测试剂盒顺利完成欧盟CE认证,并获得由荷兰公共卫生、福利与体育部(CIBG)签发的体外诊断试剂注册许可(证书编号:CIBG-20221803)。
此次获批,表明臻悦生物领先的研发能力和产品质量得到了国际权威机构的认可与肯定,产品可以在欧盟成员国及其他认可欧盟CE认证的国家上市销售。同时,也标志着臻和科技打造的肿瘤精准诊断创新器械迈向了国际化市场。


产品信息
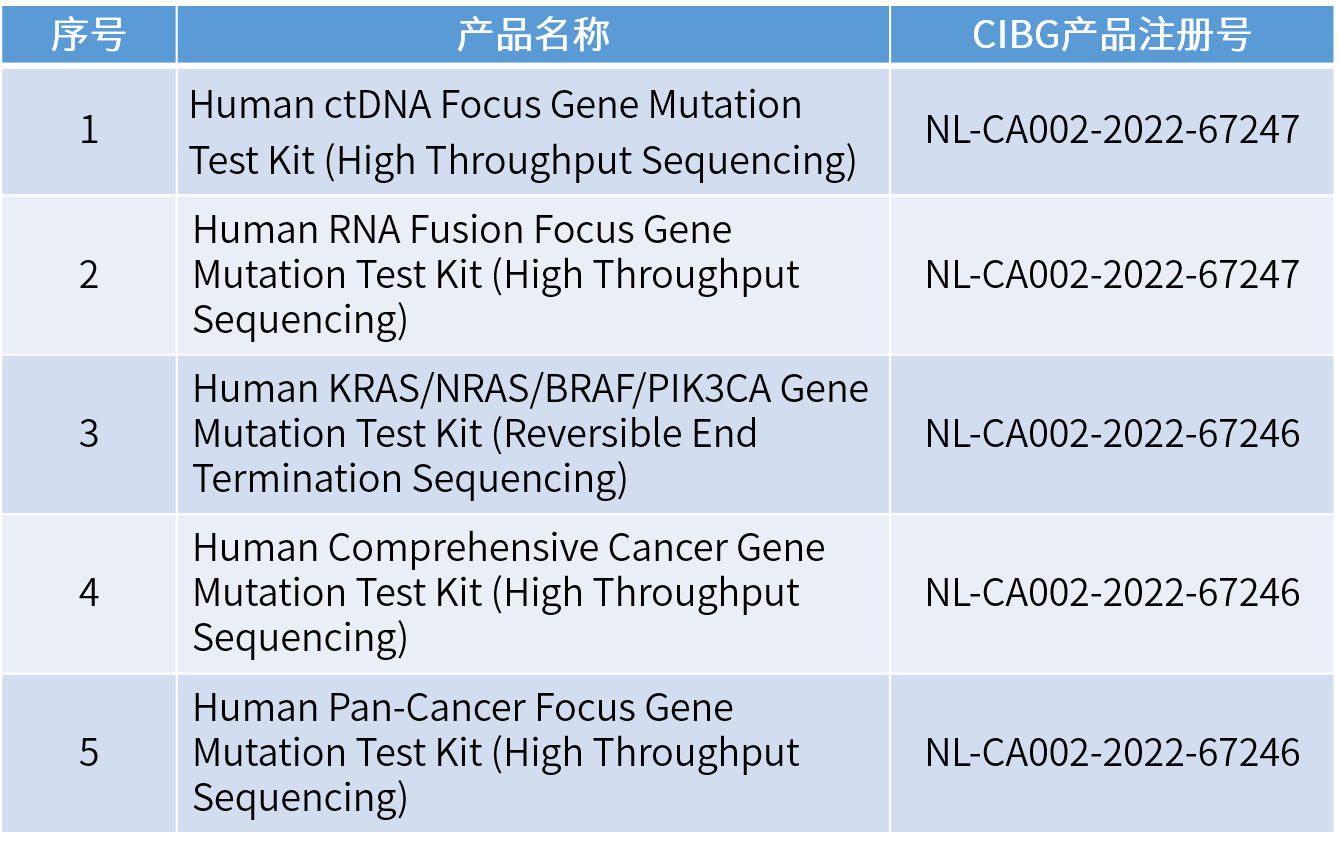
臻悦生物获批欧盟CE认证的5款产品,是基于NGS方法学的多基因肿瘤突变联合检测试剂盒,适用于非小细胞肺癌、结直肠癌、甲状腺癌、胃癌等多种实体瘤。通过对肿瘤患者的组织或血液样本进行检测,根据每个样本的检测情况提供全方位、精准的解读,可以全面指导肿瘤靶向药物治疗方案,解决靶向用药的临床需求,协助医生制定更完善的精准治疗方案,为患者争取宝贵的治疗时间和用药机会。
令人振奋的是,臻悦生物自主研发的结直肠癌NGS多基因联合检测产品“人KRAS/NRAS/BRAF/PIK3CA基因突变联合检测试剂盒(可逆末端终止测序法)”,此前已经获得了国家药品监督管理局(NMPA)三类医疗器械注册证(国械注准20213400151),是国内首款专注于结直肠癌的NGS伴随诊断试剂盒,也在本次获批欧盟CE认证的产品之列。
另一款获批的人组织多基因联合检测试剂盒(高通量测序法),商品名“臻全安™”,可以检测769个与肿瘤发生发展相关的重要通路基因,覆盖目前所有FDA/NMPA批准、NCCN指南推荐和临床试验靶向药物,能够全面检测肿瘤相关基因的点突变、插入、缺失、融合/重排、基因拷贝数变异、TMB、MSI、HLA分型等。其中370个与临床诊断、治疗或预后高度相关的基因对全外显子区域进行完整覆盖。这是一款能够全面、多维评估免疫治疗相关标志物,精准筛选免疫获益人群的试剂盒。
五款产品同时拿证“出海”,意味着臻悦生物研发投入的持续性和技术成果转化的可行性成效明显。事实上,作为臻和科技集团的体外诊断试剂生产基地,臻悦生物已经成长为集研发、生产、销售和服务为一体的国家级高新技术企业,一方面,公司源源不断地为集团的迅猛发展注入强劲动力;另一方面,依托集团在生命健康产业的部署,臻悦生物将深化产品管线研发布局,为完善产业链增添新动能。
臻悦生物负责人表示,公司在泰州中国医药城起步,每一步的发展都离不开当地政府的大力支持。公司产品获得欧盟CE认证,是臻悦生物携手中国医药城共同谱写医疗器械高质量发展最有力的响应和最实际的行动。未来,随着医疗器械产业结构的转型升级,我们期待越来越多的产品走向全球,让“中国造”领跑世界!