近日,Science推出了最新一期名为《Precision medicine and cancer immunology in China》的增刊,由10余位国内专家牵头撰写,深入探讨了中国精准医学的发展趋势及癌症免疫治疗的过去、现在和未来。

臻和科技医学团队与首都医科大学附属北京地坛医院曾辉教授共同撰写的《The role of circulating cell-free DNA in the management of cancer in China》(中文名:游离DNA在中国肿瘤患者全程管理中的临床应用)荣幸入选。
一、肿瘤患者全程管理的临床需求
恶性肿瘤已成为中国人群重要的公共健康问题。在临床实践中,需要探索和验证一系列的伴随诊断的检测平台来辅助临床决策,主要的临床需求如下:肿瘤的早期诊断,鉴别原发灶不明肿瘤的组织来源,鉴别诊断良性及恶性肿瘤;预测抗肿瘤治疗的安全性和有效性,筛选治疗获益人群;监测抗肿瘤治疗疗效,评估预后等;建立多组学的检测平台,全面展示肿瘤的分子特征,描绘肿瘤患者的全程管理过程中肿瘤细胞的克隆演化进程,从而为抗肿瘤治疗提供理论基础和研究方向。
二、游离DNA的临床应用
游离DNA在肿瘤诊断中的应用
游离DNA(cell free DNA, cfDNA)是一种胞外DNA。临床研究表明,cf-DNA能有效反映患者整体的肿瘤负荷、恶性程度、转移能力以及实时的基因突变信息,与肿瘤组织的基因信息呈一定相关性(1)。然而,血浆游离DNA(cfDNA)应用于早期肿瘤诊断仍具有一定的局限性。血浆游离DNA(cfDNA)既可以来源于肿瘤细胞又可以来源于正常细胞。在肿瘤发生的早期阶段,血浆中分离的游离DNA中,来自于肿瘤细胞的DNA片段纯度较低,可能会降低诊断的敏感性和特异性。
游离DNA鉴定肿瘤组织来源
LoYM等研究者采用全基因组重亚硫酸盐测序方法绘制了组织特异性甲基化图谱,通过生物信息学分析方法,可以根据组织特异性甲基化图谱测算血浆游离DNA中检测到基因变异的不同组织来源,研究者在孕妇、肿瘤患者、器官移植患者样本中进行了方法学验证,对于原发灶不明的肿瘤患者,采用游离DNA甲基化测序可能有助于判断肿瘤组织来源(2)。
游离DNA在靶向治疗中的应用
血浆游离DNA(cfDNA)检测已经用于非小细胞肺癌患者(NSCLC)靶向治疗获益人群选择的临床实践。FDA和EMA已经批准了血浆游离DNA(cfDNA)EGFR基因的突变检测试剂盒用于选择EGFR-TKI治疗获益患者(3-5)。
游离DNA在监测肿瘤克隆进化中的应用
TRACERx研究结果表明循环肿瘤DNA可用于监测肺癌的复发和转移的克隆演化(6)。对于需要全程监测肿瘤克隆变化的患者,反复多次留取肿瘤组织样本在临床实际工作中难度较大,血浆游离DNA检测作为非侵入性检测方法,可以用于动态监测肿瘤克隆演化进程,辅助临床决策。
cfDNA在免疫检查点药物中的应用
近期的临床试验结果对几种新的免疫检查点抑制剂的疗效给予了肯定,例如PD-1抗体(纳武单抗和派姆单抗)和PD-L1抗体(阿特珠单抗),在几种癌症的临床试验中均有较好疗效(7-11)。在评估免疫疗法疗效时,游离DNA检测结果的变化可能要早于影像学的变化。一项前瞻性研究发现,对于那些接受了纳武单抗或者派姆单抗治疗的肺癌、黑色素瘤、微卫星序列不稳定的结直肠癌患者,治疗到第八周时游离DNA检测结果阴性是重要的积极预后因子(无进展生存期和总生存期较长)(12)。目前,中国本土药企如江苏恒瑞医药股份有限公司,上海君实生物医药科技有限公司,百济神州生物科技有限公司,信达生物制药有限公司等研发的PD-1/PD-L1抑制剂均处于临床试验阶段。在这些试验中,上述可能影响药物疗效的生物标记物的信息、资料应该被参考,并且设计相关试验。
cfDNA在T细胞过继回输免疫疗法中的应用
在中国,树突状细胞诱导的杀伤性T细胞过继回输疗法仍然是最为常见的T细胞免疫疗法,主要用于治疗恶性血液病。但是,此种疗法对于其他肿瘤的疗效并没有得到进一步探究。因此,急需要一种合适的生物标记物来找出适合接受T细胞免疫治疗的患者并且预测疗效,肿瘤来源的游离DNA相关的生物标记物可能具有应用价值。
三、中国开展的游离肿瘤组织DNA临床试验
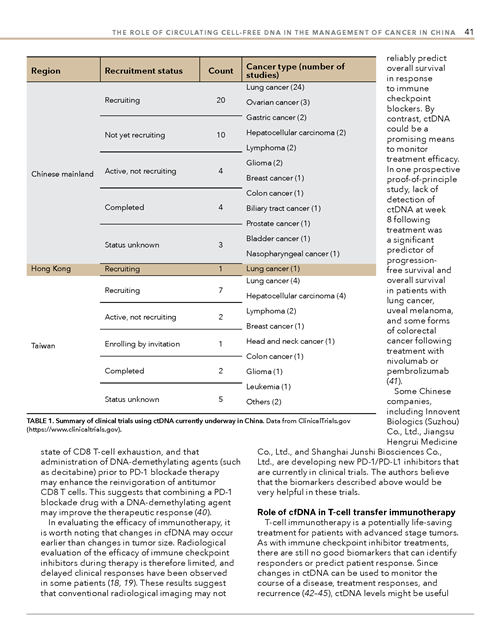
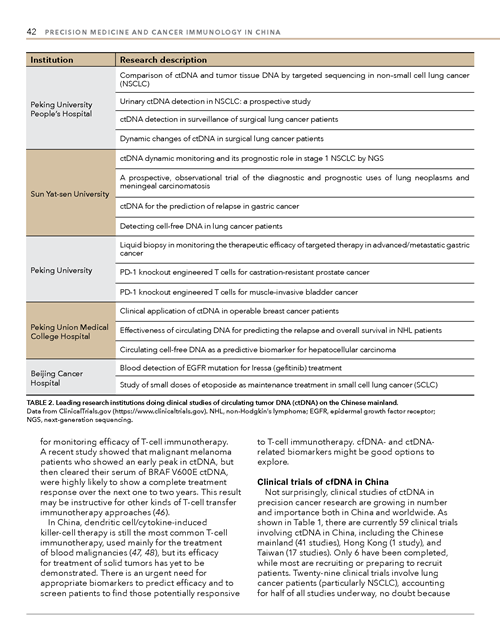
目前一共有59个关于癌症组织游离DNA的临床试验在中国展开,其中41个在中国大陆,1个在香港,17个在台湾。在这些研究中,仅有6个已经完成,大部分的临床试验还在招募阶段或者准备招募阶段。关于癌症种类,29个临床试验以肺癌患者展开,超过一半的临床试验是以非小细胞肺癌患者展开的,远远超过其他恶性肿瘤。在中国,肿瘤组织游离DNA临床研究的申办方,除了阿斯利康,大多是国内的大学,医院和公司。
四、研究展望
游离DNA检测在将来可能应用到肿瘤的诊断以及治疗,然而仍然需要关注和解决一些问题。首先,游离DNA相关的临床数据库应该以中国患者为基础建立,解决这一问题的可行方案是进行真实世界研究。游离DNA的临床研究应该贯穿肿瘤诊疗的全程,包括早期诊断,肿瘤组织来源的鉴别,化疗药物选择,放射治疗选择,靶向药物治疗或者手术后免疫治疗选择,以及如何调整治疗方案等。相关临床试验设计应该是规范的、多中心的,患者的临床数据和随访数据的真实性和完整性应该被重视。其次,在开展相关临床试验时,如果实验设计中包含二代测序的内容,应该被尽可能地遵照现有的二代测序国际标准和中国标准。基于游离DNA的二代测序标准也应该被建立起来,从而使临床试验的结果更加准确、易于整理、比较和总结。最后,政府和医疗产业界应该加大投资到这些研究中从而帮助研究者建立一个大型的数据收集模型,包括游离DNA应用的临床数据、以及相关的早期癌症筛查方法和治疗方案等。
附:杂志截图





参考文献
1.Schwarzenbach H, Hoon DS, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients. Nat Rev Cancer 2011;11:426-437.
2.Sun K, Jiang P, Chan KC, Wong J, Cheng YK, Liang RH, Chan WK, et al. Plasma DNA tissue mapping by genome-wide methylation sequencing for noninvasive prenatal, cancer, and transplantation assessments. Proc Natl Acad Sci U S A 2015;112:E5503-5512.
3.FDA. FDA: http://www.accessdata.fda.gov/cdrh_docs/pdf15/P150047a.pdf.
4.EMA. EMA: http://www.ema.europa.eu/docs/en_GB/document_library/ EPAR_-_Product_Information/human/001016/WC500036358.pdf (2016).
5.EMA. EMA: http://www.ema.europa.eu/docs/en_GB/document_library/ EPAR_-_Product_Information/human/004124/WC500202022.pdf (2016).
6.Abbosh C, Birkbak NJ, Wilson GA, Jamal-Hanjani M, Constantin T, Salari R, Le Quesne J, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature 2017;545:446-451.
7.Brahmer J, Reckamp KL, Baas P, Crino L, Eberhardt WE, Poddubskaya E, Antonia S, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med 2015;373:123-135.
8.Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, Schadendorf D, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015;373:23-34.
9.Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, Skora AD, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015;372:2509-2520.
10.Motzer RJ, Escudier B, McDermott DF, George S, Hammers HJ, Srinivas S, Tykodi SS, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015;373:1803-1813.
11.Nghiem PT, Bhatia S, Lipson EJ, Kudchadkar RR, Miller NJ, Annamalai L, Berry S, et al. PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med 2016;374:2542-2552.
12.Cabel L, Riva F, Servois V, Livartowski A, Daniel C, Rampanou A, Lantz O, et al. Circulating tumor DNA changes for early monitoring of anti-PD1 immunotherapy: a proof-of-concept study. Ann Oncol 2017.