
肺癌是世界上最常见的恶性肿瘤,死亡率也居高不下,近年来随着各种治疗方式的发展,越来越多的患者获得生存的改善。诸多研究表明虽然PD-L1表达与抗PD-1/PD-L1药物疗效相关,但并不能够独立的预测患者免疫检查点抑制剂治疗的疗效。
此外,肿瘤突变负荷(TMB)虽能够预测NSCLC免疫治疗疗效(写入指南),但其对传统化疗和靶向治疗的预测作用尚未阐释清楚。
因此,臻和科技与马海涛教授、戴纪刚教授、陈志明副教授和刘权兴医生合作,探究了PD-L1表达和TMB作为中国人群肺腺癌和肺鳞癌患者化疗和靶向治疗预后的生物标志物的潜力。文章发表于J Exp Clin Cancer Res杂志,影响因子为6.217。
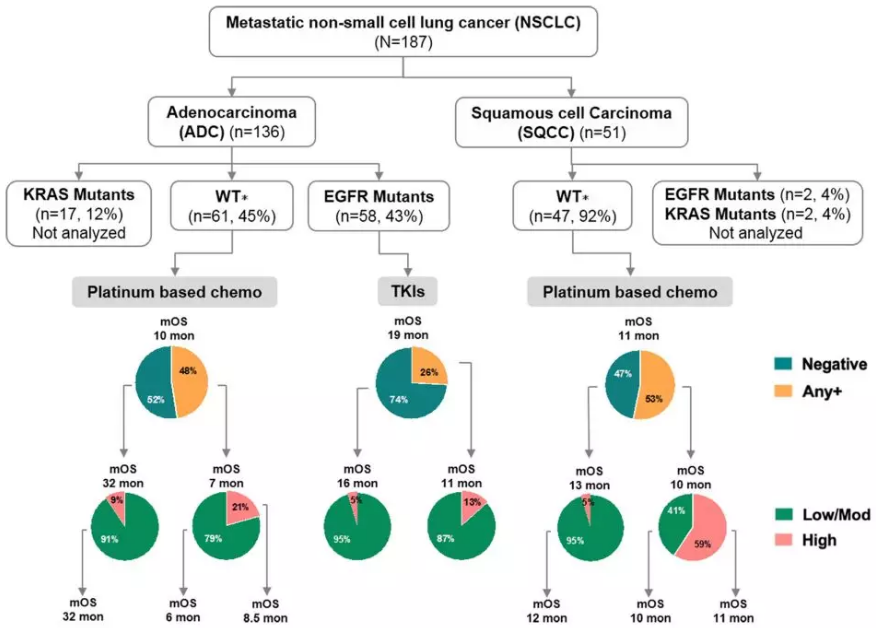
入组患者:187例转移性NSCLC患者,排除既往恶性肿瘤病史、非肺部腺/鳞癌和ALK/BRAF/ERBB2/MET/RET/ROS1突变患者。入组腺癌患者n=136(73%),鳞癌患者n=51(27%),患者年龄、性别、吸烟情况或病理分期没有显著差异,但腺癌患者携带EGFR和KRAS基因突变的比例显著高于鳞癌患者(EGFR: 43% vs 4%; KRAS: 12% vs 4%)。
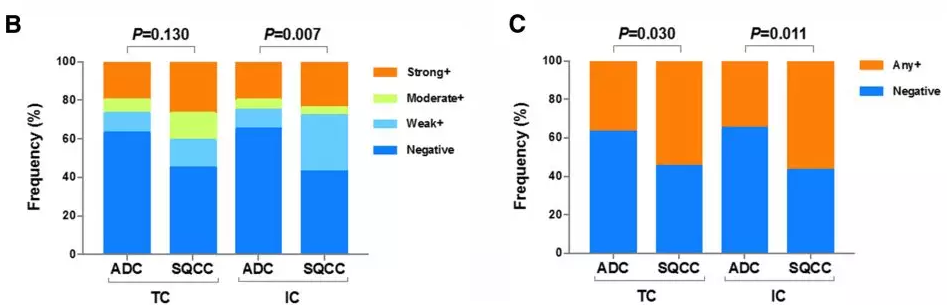
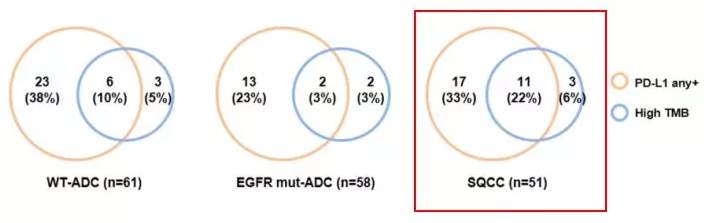
在入组患者中,55%鳞癌和37%腺癌患者表达了PD-L1(任意强度),无论是肿瘤细胞还是免疫细胞,鳞癌PD-L1表达均高于腺癌。
检测手段:利用IHC检测PD-L1表达,臻和1086肿瘤相关基因NGS panel测序。
结果与讨论:
PD-L1表达与肺腺癌患者预后呈负相关
在肺腺癌组中,携带EGFR突变患者和肿瘤细胞表达PD-L1阴性患者mOS更长(图A、B)。且无论患者是否携带EGFR突变,肿瘤细胞PD-L1表达阴性亚组mOS均显著延长(图C、D)。
在鳞癌组中没有观察到PD-L1与预后间的关联(图E、F)。肺腺癌和肺鳞癌患者中均未发现预后与免疫细胞PD-L1表达相关。肿瘤浸润CD8+T细胞分析表明:无论PD-L1是否表达,CD8+T细胞浸润情况没有差异。
TMB是有潜力的生物标志物
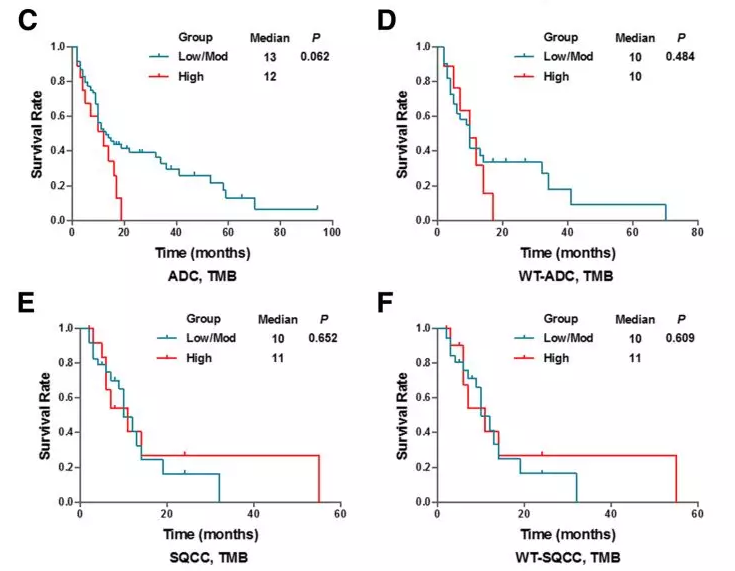
通过1086基因的靶向测序检测TMB,中位TMB为8.0 mut/Mb(0-58 mut/Mb),鳞癌亚组的TMB稍高于腺癌亚组。

研究中把TMB划分为三个等级:高(≥13.7)/中(2.2≤TMB<13.7)/低(<2.2)。如图C-F中所示,似乎高TMB的腺癌患者的预后更差(不显著),而在鳞癌患者中TMB的差异与疗效无关。此趋势与PD-L1表达相似,所以研究者提出,TMB联合PD-L1可能能够更好的预测患者的疗效。
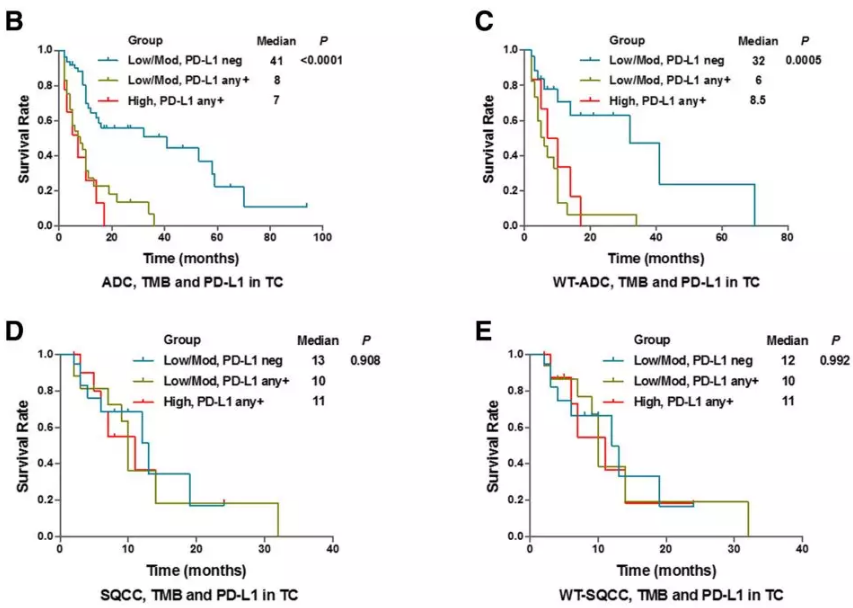
PD-L1表达联合TMB可作为肺腺癌患者的预后标志物
为了验证这一假说,研究者对“低/中TMB+PD-L1阴性”、“低/中TMB+PD-L1阳性”、“高TMB+PD-L1阳性”三个亚组的患者的中位生存期进行分析,结果显示“低/中TMB+PD-L1阴性”腺癌患者的mOS为41个月,显著优于其他两组(B)。而在鳞癌患者中却没有观察到相同的现象。
综合以上结果可以得出结论,PD-L1表达与肺腺癌患者靶向治疗和化疗预后呈负相关,TMB虽不是独立的标志物,但是对PD-L1的有效补充。我们预测原因之一可能在于PD-L1表达阴性的患者缺乏免疫抑制因子,从而具有更强的抗肿瘤免疫力。而低/中等TMB可能与产生免疫原性新抗原相关基因失调有关。当然,这一假设需要更多进一步验。
本研究发现,在肺鳞癌中PD-L1表达和高TMB的重合高于腺癌,但二者没有显著的相关性。还期待更深入的研究探索二者之间的关联。
此外,研究还发现在本试验队列中,肺腺癌患者EGFR突变的比例高于西方人群,因此本研究结果对亚洲人群靶向治疗的意义更大。